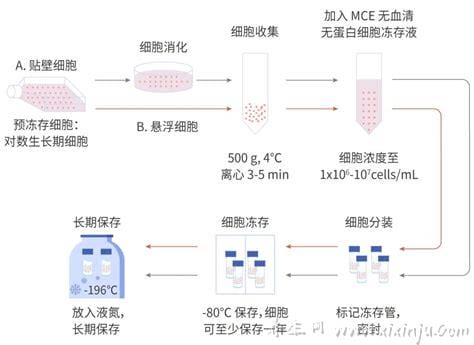
(A)细胞冷冻保存
1.制备含有10%DMSO或甘油和10-20%小牛血清的冻存培养液;
2.取对数生长期的细胞,去除旧的培养液,用PBS洗涤。
3.去除PBS,加入适量胰蛋白酶(覆盖培养皿表面)消化单层细胞;
4.以1000转/分钟的速度离心5min
5.去除胰蛋白酶,加入适量配制好的冻存培养液,用吸管轻吹使细胞均匀,计数,将冻存液中细胞的最终密度调整为5×106/ml ~ 1×107/ml;
6.将细胞放入冻存管中,每管1 ~ 1.5毫升;
7.在冻存管上注明细胞名称、冻存时间和操作者;
8.冷冻:标准冷冻程序为-1 ~-2℃/分钟的降温速率;当温度低于-25℃时,可提高到-5℃~ 10℃/分钟;当它达到-100℃时,可以迅速浸入液氮中。或者,可以将装有细胞的冻存管放入-20℃的冰箱中2h,再放入-70℃的冰箱中过夜,然后取出冻存管移入液氮容器中。
(2)细胞复苏
1.将冻管从液氮容器中取出,直接浸入37℃的温水中,并不时摇动,使其尽快融化。
2.从37℃水浴中取出冻存管,打开盖子,用吸管吸出细胞悬液,加入离心管中,滴加10倍以上培养液,混匀;
3.以1000转/分钟的速度离心5min
4.弃去上清液,加入含10%小牛血清的培养液重悬细胞,计数,调整细胞密度,接种培养瓶,置于37℃培养箱中培养;
5.第二天更换一次培养液,继续培养。
需要注意的事项
1.培养细胞从增殖期到形成致密单层细胞都可以用于冻存,但最好使用对数生长期细胞。最好在冷冻前一天更换培养基;
2.冻管放入或取出液氮容器时,应做好防护,以免冻伤;
3.冷冻保存和复苏最好使用新配制的培养基。